Năng lượng của Electron vô nguyên vẹn tử :
+) Mức tích điện obitan nguyên vẹn tử : 
Bạn đang xem: mỗi obitan nguyên tử chứa tối đa
Trong nguyên vẹn tử, những electron bên trên từng obitan sở hữu một nấc tích điện xác lập. Người tao gọi nấc tích điện này là nấc tích điện obitan nguyên vẹn tử (mức tích điện AO)
Các electron bên trên những obitan không giống nhau của và một phân lớp sở hữu tích điện như nhau. Thí dụ : Ứng với n=2, tao sở hữu 2 phân lớp là 2s và 2p. Phân lớp 2s chỉ tồn tại một obitan 2s, còn phân lớp 2p sở hữu 3 obitan : 2px,2py,2pz. Các electron của những obitan p vô phân lớp này tuy rằng sở hữu sự triết lý vô không khí không giống nhau, tuy nhiên bọn chúng sở hữu nằm trong nấc tích điện AO.
+) Trật tự động những nấc tích điện obitan nguyên vẹn tử
Thực nghiệm và lí thuyết đã cho chúng ta biết khi số hiệu nguyên vẹn tử Z tăng, những nấc tích điện AO tăng dần dần theo dõi trình tự động sau :
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d....
Từ trình tự động nấc tích điện AO bên trên đã cho chúng ta biết khi năng lượng điện phân tử nhân tăng sở hữu sự chèn nấc tích điện, nấc 4s trở thành thấp rộng lớn 3d, nấc 5s thấp rộng lớn 4d,6s thấp rộng lớn 4f,5d,...
+) Các nguyên vẹn lí và quy tắc phân bổ Electron vô nguyên vẹn tử
Sự phân bổ những electron vô nguyên vẹn tử tuân theo dõi nguyên vẹn lí Pau-li, nguyên vẹn lí vững chắc và quy tắc Hun (F.Hund).
+) Nguyên lí Pau-li :
- Ô lượng tử
Để trình diễn obitan nguyên vẹn tử một cơ hội đơn giản và giản dị, người tao còn sử dụng dù vuông nhỏ, được gọi là dù lượng tử. Một dù lượng tử ứng với cùng một AO. Thí dụ : Ứng với n=1 chỉ tồn tại một onitan 1s, tao vẽ một dù vuông. Ứng với n=2 sở hữu một obitan 2s và phụ thân obitan 2p(2px,2py,2pz), tao vẽ một dù vuông nằm trong phân lớp 2s và phụ thân dù vuông này được vẽ ngay lập tức nhau, nhằm chỉ rằng những obitan 2p sở hữu nằm trong nấc tích điện AO, tuy nhiên cao hơn nữa AO−2s như hình vẽ sau :
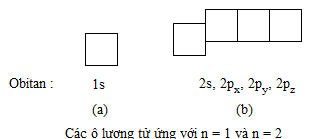
- Nguyên lí Pau-li
Trên một obitan chỉ hoàn toàn có thể có tương đối nhiều nhất là nhị electron và nhị electron này hoạt động tự động cù không giống chiều nhau xung xung quanh trục riêng rẽ của từng electron. Người tao biểu thị chiều tự động cù không giống nhau xung quanh trục riêng rẽ của nhị electron vì chưng 2 mũi thương hiệu nhỏ : Một mũi thương hiệu sở hữu chiều tăng trưởng, một mũi thương hiệu sở hữu chiều trở xuống. Trong một obitan vẫn sở hữu 2 electron, thì 2 electron bại liệt gọi là electron ghép song. Khi obitan chỉ tồn tại một electron thì electron bại liệt gọi là electron đơn thân.

- Số electron tối nhiều vô một tờ và vô một phân lớp
. Số electron tối nhiều vô một tờ electron : Ta vẫn biết lớp n2 obitan. Mỗi obitan theo dõi nguyên vẹn lí Pau-li sở hữu tối nhiều 2 electron. Do bại liệt : Lớp n sở hữu tối nhiều 2 n2 electron.
. Số electron tối nhiều vô một phân lớp electron. Cũng theo dõi nguyên vẹn lí Pau-li, tao hoàn toàn có thể hiểu rằng số electron tối nhiều vô một phân lớp. Phân lớp s chỉ tồn tại một obitan, vậy chỉ mất tối nhiều 2 electron. Phân lớp p sở hữu 3 obitan nên sở hữu tối nhiều 6 electron, tương tự động phân lớp d sở hữu tối nhiều 10 electron, phân lớp f sở hữu tối nhiều 14 electron. Ta hoàn toàn có thể trình diễn số electron tối nhiều trong số phân lớp vì chưng những dù lượng tử như hình vẽ dưới

Một cách thứ hai, nhằm trình diễn tình trạng electron của obitan 1s chứa chấp 2 electron tao sử dụng kí hiệu : 1s2. Tại trên đây, số 1 đứng phía bên trái chỉ lớp n=1, chữ s chỉ obitan s, số 2 ở phía bên trên ở bên phải chỉ số electron sở hữu chứa chấp vô obitan 1s. Giả sử phân lớp 2p sở hữu 6 electron, tao ghi chép : 2p6.
Các phân lớp : s2,p6,d10,f14 sở hữu đầy đủ số electron tối nhiều gọi là phân lớp bão hoà. Còn phân lớp ko đầy đủ số electron tối nhiều gọi phân lớp ko bão hoà. Thí dụ những phân lớp s1 , p3,d7,f12....
+) Nguyên lí vững chắc :
Ở tình trạng cơ bạn dạng, vô nguyên vẹn tử những electron cướp thứu tự những obitan sở hữu nấc tích điện kể từ thấp cho tới cao.
Thí dụ :
Nguyên tử hiđro (Z=1) có một electron, electron này tiếp tục cướp obitan 1s(AO−1s) sở hữu nấc tích điện thấp. Do bại liệt hoàn toàn có thể trình diễn sự phân bổ electron của nguyên vẹn tử hiđro là 1s1; Biểu trình diễn vì chưng dù lượng tử là : 
Xem thêm: hôm nay là thứ bảy
Nguyên tử heli (Z=2) sở hữu 2 electron. Theo nguyên vẹn lí Pau-li, nhị electron này nằm trong cướp obitan 1s sở hữu nấc tích điện thấp nhất. Bởi vậy sự phân bổ electron bên trên obitan của heli là 1s2→ 
Nguyên tử liti (Z=3) sở hữu 3 electron, 2 electron trước cướp obitan 1s và vẫn bão hoà, electron sót lại cướp obitan 2s tiếp theo sau sở hữu nấc tích điện cao hơn nữa. Do bại liệt sự phân bổ electron bên trên những obitan của liti là :
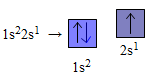
Một cơ hội tương tự động, tao hoàn toàn có thể ghi chép được sự phân bổ electron bên trên những obitan của những yếu tố tiếp theo sau.
Thí dụ :

Tuy nhiên, ko nhất thiết khi nào thì cũng nên trình diễn những AO−2p nên cao hơn nữa AO−2s,... vì như thế tiếp tục kềnh càng. Người tao chỉ trình diễn sự cao, thấp của những dù lượng tử khi cần thiết thể hiện tại nấc tích điện không giống nhau của từng phân lớp electron.
+) Quy tắc Hun
Trong và một phân lớp, những electron tiếp tục phân bổ bên trên những obitan sao mang lại số electron đơn thân là tối nhiều và những electron này nên sở hữu chiều tự động cù tương đương nhau.
Thí dụ sự phân bổ electron bên trên những obitan của nguyên vẹn tử cacbon, nitơ như sau :

Các electron đơn thân vô một nguyên vẹn tử được kí hiệu vì chưng những mũi thương hiệu nằm trong chiều, thông thường được ghi chép phía lên bên trên.
Cấu hình Electron nguyên vẹn tử :
+) Cấu hình electron nguyên vẹn tử
Xem thêm: sơ xuất hay sơ suất
Cấu hình electron nguyên vẹn tử trình diễn sự phân bổ electron bên trên những phân lớp với mọi lớp không giống nhau.
Quy ước cơ hội ghi chép thông số kỹ thuật electron nguyên vẹn tử :
- Số trật tự lớp electron được ghi chép vì chưng những chữ số (1,2,3...)
- Phân lớp được kí hiệu vì chưng vần âm thông thường (s,p,d,f)
- Số electron được ghi vì chưng chỉ số ở phía bên trên, ở bên phải kí hiệu của phân lớp (s2 , p2,...)
Cách ghi chép thông số kỹ thuật electron nguyên vẹn tử :
- Xác ấn định số electron của nguyên vẹn tử.
- Các electron được phân bổ theo dõi trật tự tăng dần dần những nấc tích điện AO, theo dõi những nguyên vẹn lí và quy tăc phân bổ electron vô nguyên vẹn tử.
- Viết thông số kỹ thuật electron theo dõi trật tự những phân lớp bên trong một tờ và theo dõi trật tự của những lớp electron
Thì dụ :
Na (Z = 11) sở hữu 11 electron. Cấu hình electron của Na như sau : 1s22s22p63s1
Fe (Z = 26) sở hữu 26 electron. Do sở hữu sự chèn nấc tích điện, những electron được phân bổ như sau : 1s22s22p63s23p64s23d6
Sau bại liệt nên bố trí những phân lớp theo dõi từng lớp : 1s22s22p63s23p63d64s2
Hoặc ghi chép gọn gàng là : [Ar]3d64s2
[Ar] là kí hiệu thông số kỹ thuật electron nguyên vẹn tử của yếu tố agon, là khí khan hiếm sớm nhất đứng trước Fe.
+) Cấu hình electron nguyên vẹn tử của một vài yếu tố :
Dựa vô những nguyên vẹn lí và quy tắc nêu phía trên tao hoàn toàn có thể thiết kế thông số kỹ thuật electron nguyên vẹn tử của những yếu tố không giống. Dưới đấy là thông số kỹ thuật electron nguyên vẹn tử của đôi mươi yếu tố thứ nhất vô bảng tuần trả.
+) Đặc điểm của lớp electron ngoài cùng
Các electron ở phần ngoài nằm trong đưa ra quyết định đặc thù hoá học tập của một yếu tố.
- Đối với nguyên vẹn tử của những yếu tố, số electron phần ngoài nằm trong tối nhiều là 8. Các nguyên vẹn tử sở hữu 8 electron phần ngoài nằm trong thường rất kiên cố, bọn chúng đa số ko nhập cuộc vô những phản xạ hoá học tập. Đó là những nguyên vẹn tử khí khan hiếm ( trừ He sở hữu số electron phần ngoài nằm trong là 2)
- Các nguyên vẹn tử có một,2,3 electron ở phần ngoài nằm trong là những nguyên vẹn tử sắt kẽm kim loại ( trừ H, He và B)
- Các nguyên vẹn tử sở hữu 5,6,7 electron ở phần ngoài nằm trong là những nguyên vẹn tử phi kim.
- Các nguyên vẹn tử sở hữu 4 electron ớ phần ngoài nằm trong hoàn toàn có thể là nguyên vẹn tử sắt kẽm kim loại hoặc phi kim.











Bình luận