I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Các thành phần vô bảng tuần trả được bố trí theo hướng tăng dần dần của năng lượng điện phân tử nhân vẹn toàn tử.
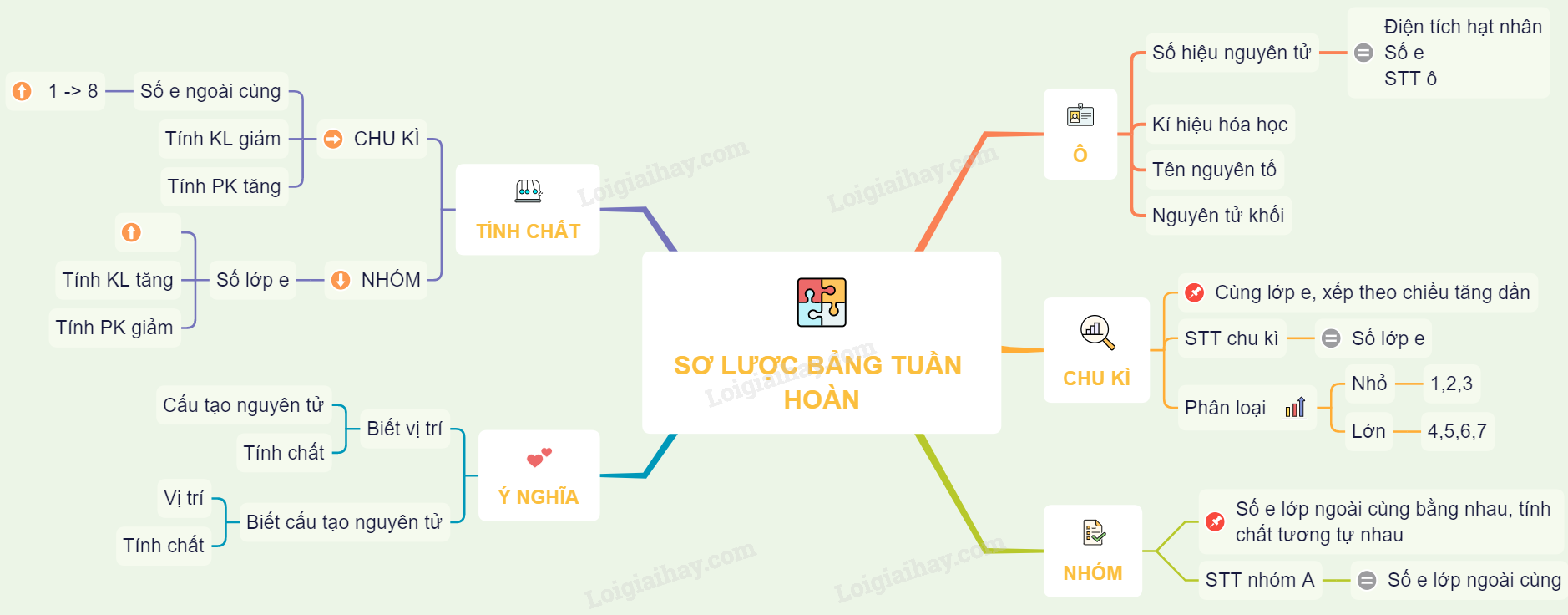
II. CẤU TẠO BẢNG TUẦN HOÀN
1. Ô vẹn toàn tố
Bạn đang xem: bảng tuần hoàn hóa học lớp 9
- Ô thành phần mang đến biết: Số hiệu vẹn toàn tử, kí hiệu chất hóa học, thương hiệu thành phần, vẹn toàn tử khối của thành phần tê liệt.
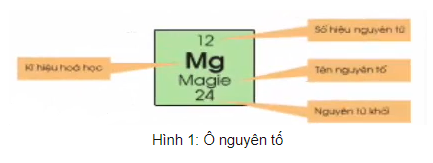
- Số hiệu vẹn toàn tử có số trị thông qua số đơn vị chức năng năng lượng điện phân tử nhân và thông qua số electron vô vẹn toàn tử. Số hiệu vẹn toàn tử trùng với số trật tự dù vô bảng tuần trả.
Ví dụ: Ô loại 11, xếp thành phần natri (Na).
Ta có:
+ Số hiệu vẹn toàn tử = số proton = số electron = 11
+ Kí hiệu hóa học: Na
+ Tên vẹn toàn tố: natri
+ Nguyên tử khối: 23
2. Chu kì
- Chu kỳ là sản phẩm những thành phần nhưng mà vẹn toàn tử của bọn chúng sở hữu nằm trong số lớp electron và được xếp theo hướng năng lượng điện phân tử nhân tăng dần dần.
- Số trật tự chu kì bằng số lớp electron.
- Bảng tuần trả bao gồm sở hữu 7 chu kỳ: chu kỳ luân hồi 1, 2, 3 là những chu kỳ luân hồi nhỏ. Chu kỳ 4, 5, 6, 7 là những chu kỳ luân hồi rộng lớn.
Ví dụ: chu kì 3: chính thức là sắt kẽm kim loại kiềm Na và kết đôn đốc là khí trơ: Ar (agon)
- Nhóm gồm những thành phần nhưng mà vẹn toàn tử của bọn chúng sở hữu số electron lớp bên ngoài nằm trong cân nhau, bởi vậy sở hữu đặc thù tương tự động nhau được xếp trở thành một cột theo hướng tăng của năng lượng điện phân tử nhân vẹn toàn tử.
- Số trật tự của những nhóm A thông qua số electron ở lớp bên ngoài nằm trong của vẹn toàn tử vô group tê liệt.
Ví dụ:
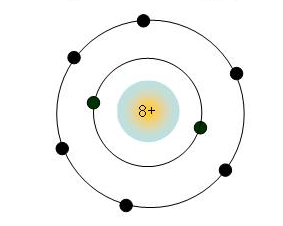
+ Nhóm IA: Gồm những thành phần sắt kẽm kim loại hoạt động và sinh hoạt mạnh. Nguyên tử của bọn chúng đều có một electron ở lớp bên ngoài nằm trong. Điện tích phân tử nhân tăng kể từ Li (3+), … cho tới Fr (87+).
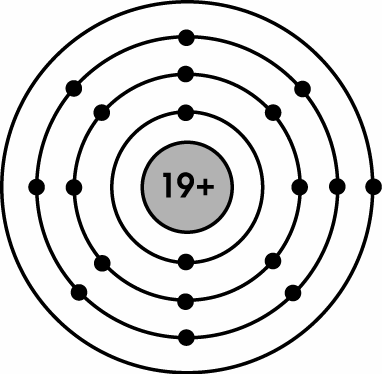
+ Mô phỏng cấu trúc vẹn toàn tử Kali ở group IA, có một electron ở lớp bên ngoài cùng:
III. SỰ BIỂN ĐỔI TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
1. Trong một chu kì
- Trong một chu kỳ luân hồi, Lúc chuồn từ trên đầu cho tới cuối chu kỳ luân hồi theo hướng tăng của năng lượng điện phân tử nhân:
+ Số e lớp bên ngoài cùng của vẹn toàn tử tăng dần dần từ một cho tới 8 electron.
+ Tính kim loại của những vẹn toàn tố giảm dần, đồng thời tính phi kim của những thành phần tăng dần dần.
Ví dụ:
Xem thêm: tính diện tích hình bình hành
Chu kì 2 bao gồm 8 vẹn toàn tố:
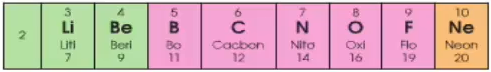
+ Số e lớp bên ngoài nằm trong của vẹn toàn tử những thành phần vô chu kỳ luân hồi 2 tăng dần dần từ một cho tới 8
+ Đẩu chu kỳ luân hồi 2 là 1 trong sắt kẽm kim loại mạnh (Li), cuối chu kỳ luân hồi là 1 trong phi kim mạnh (F), kết đôn đốc chu kỳ luân hồi là 1 trong khí khan hiếm (Ne).
2. Trong một nhóm
Trong một group, Lúc chuồn kể từ bên trên xuống bên dưới theo hướng tăng của năng lượng điện phân tử nhân.
- Số lớp electron của vẹn toàn tử tăng dần dần.
- Tính kim loại của những vẹn toàn tố tăng dần, đồng thời tính phi kim của những thành phần tách dần dần.
Ví dụ: Nhóm IA bao gồm 6 thành phần từ Li đến Fr
+ Số lớp electron tăng dần dần kể từ 2 cho tới 7. Số electron lớp bên ngoài nằm trong của vẹn toàn tử đều vì chưng 1.
+ Tính sắt kẽm kim loại của những thành phần tăng dần dần. Đầu group IA, Li là sắt kẽm kim loại hoạt động và sinh hoạt chất hóa học mạnh cuối group là sắt kẽm kim loại Fr hoạt động và sinh hoạt chất hóa học rất rất mạnh
IV. Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. hiểu địa điểm của thành phần tao rất có thể suy luận cấu trúc vẹn toàn tử và đặc thù của thành phần.
Ví dụ:
Biết: Nguyên tố A sở hữu số hiệu vẹn toàn tử là 17, chu kì 3, group VIIA.
Xác ấn định được:
+ Nguyên tố A sở hữu số hiệu vẹn toàn tử là 17, suy rời khỏi năng lượng điện phân tử nhân của vẹn toàn tử A là 17+, vẹn toàn tử A sở hữu 17 electron.
+ A ở chu kì 3, suy rời khỏi vẹn toàn tử A sở hữu 3 lớp electron. Vì ở sát cuối chu kì 3 nên A là 1 trong phi kim mạnh, tính phi kim của A mạnh rộng lớn của thành phần trước nó vô nằm trong chu kì (là S sở hữu số hiệu là 16).
+ A ở group VIIA nên lớp bên ngoài nằm trong sở hữu 7 electron, tính phi kim của A yếu hèn rộng lớn của thành phần phía bên trên nó vô nằm trong group (là F sở hữu số hiệu vẹn toàn tử là 9) tuy nhiên mạnh rộng lớn thành phần đứng bên dưới nó vô nằm trong group (là Br sở hữu số hiệu vẹn toàn tử là 35).
2. hiểu cấu trúc vẹn toàn tử của thành phần rất có thể suy luận địa điểm và đặc thù thành phần tê liệt.
Ví dụ:
Biết: Nguyên tố X sở hữu năng lượng điện phân tử nhân là 11+, vẹn toàn tử X sở hữu 3 lớp electron, lớp bên ngoài nằm trong có một electron.
Xác ấn định được:
+ Nguyên tử X sở hữu năng lượng điện phân tử nhân là 11+ suy rời khỏi X ở dù 11
+ Nguyên tử X sở hữu 3 lớp electron nên X ở chu kỳ luân hồi 3
+ Nguyên tử X sở hữu 1e ở lớp bên ngoài nằm trong nên X ở group IA.
Xem thêm: so sánh hướng động và ứng động
- Nguyên tố X là sắt kẽm kim loại vì thế ở đầu chu kì
Sơ vật dụng tư duy: Sơ lược về bảng tuần trả những thành phần hoá học











Bình luận